再生医療製品の開発において、細胞の品質管理は安全性と有効性を担保するうえで最も重要な基盤となります。特に、使用する細胞が計画通りのものであることを証明する「細胞の同一性試験」は、承認申請に向けて避けては通れないプロセスです。
研究開発の初期段階では軽視されがちですが、細胞の取り違えや交叉汚染(クロスコンタミネーション)は、長年の研究成果を無に帰すだけでなく、患者様の安全を脅かす重大なリスクとなり得ます。そのため、規制当局も厳格なガイドラインを設けており、確実なデータに基づく証明が求められています。
本記事では、再生医療製品開発に関わる品質管理担当者の方に向けて、細胞の同一性試験(STRプロファイリング等)の重要性から、具体的な試験手順、結果の解釈、そして委託先の選定ポイントまでを詳しく解説いたします。確かな品質保証体制の構築にお役立てください。
細胞の同一性試験(STRプロファイリング)は再生医療製品の品質を保証する必須プロセス
再生医療製品の品質を保証するためには、原材料である細胞そのものの同一性を確立することが不可欠です。細胞が本来の由来と一致していることを証明するプロセスは、科学的な妥当性を確保する第一歩といえます。ここでは、その中心的な手法であるSTRプロファイリングの重要性と、品質管理における位置づけについて解説します。
細胞株の同一性(Identity)を科学的に証明するSTR解析の重要性
細胞株の同一性(Identity)を科学的に証明するために、現在最も信頼性が高く、ゴールドスタンダードとして確立されている手法がSTR(Short Tandem Repeat)解析です。STRプロファイリングとも呼ばれるこの手法は、DNA上の特定の繰り返し配列(マイクロサテライト)の回数が個人によって異なることを利用しています。
ヒト由来の細胞であれば、このパターンを解析することで、指紋のように個体を識別することが可能です。形態観察や発現マーカーの確認だけでは判別が難しい、ドナーごとの違いや、他人の細胞の混入を明確に検出できる点が大きな特徴です。科学的なエビデンスとして、この客観的なデータは非常に強力な証明となります。
再生医療における品質管理(QC)と細胞認証の結論
再生医療における品質管理(QC)において、細胞認証はすべての試験の前提となる「基盤」です。もし細胞の同一性が保証されていなければ、その後の安全性試験や有効性試験の結果もすべて信頼性を失ってしまうからです。
細胞の取り違えや他細胞からの汚染(クロスコンタミネーション)は、決して稀な事故ではありません。過去には多くの研究用細胞株がHeLa細胞などに汚染されていた事実が判明し、大きな問題となりました。製品の品質を恒常的に確保し、製造工程の安定性を証明するためにも、定期的な細胞認証をQCプログラムに組み込むことが推奨されます。
規制当局のガイドラインと細胞認証が必要な背景理由
なぜ今、細胞の同一性試験がこれほどまでに重視されているのでしょうか。その背景には、国際的な規制調和の流れと、過去の苦い経験から得られた教訓があります。規制当局が求める要件と、その根拠となるリスクについて詳しく見ていきましょう。
ICH Q5DおよびPMDAが求める細胞基剤の特性解析
医薬品規制調和国際会議(ICH)のガイドライン「ICH Q5D:生物薬品(バイオテクノロジー応用医薬品/生物起源由来医薬品)製造用細胞基剤の由来、調製及び特性解析」において、細胞基剤の同一性確認は必須項目として位置づけられています。
また、日本のPMDA(独立行政法人医薬品医療機器総合機構)も、再生医療等製品の製造管理および品質管理において、細胞の同一性を確認することを求めています。これは、原材料となる細胞がマスターセルバンク(MCB)やワーキングセルバンク(WCB)から製造終了まで一貫して同一であることを保証するためであり、承認申請資料(CTD)においても重要なパートを占めます。
細胞の交叉汚染(クロスコンタミネーション)と取り違えのリスク
細胞培養の現場において、最も警戒すべきリスクの一つが「交叉汚染(クロスコンタミネーション)」と「取り違え」です。これらは、無菌操作を行っていても、操作ミスやエアロゾルを介して発生する可能性があります。
特に、増殖力の強い細胞株(例:HeLa細胞など)が実験室内に存在する場合、意図せず他の培養系に混入し、本来の細胞を駆逐して置き換わってしまう事例が数多く報告されています。このような事態が発生すれば、製品の安全性プロファイルが根本から覆ることになりかねません。リスクマネジメントの観点からも、同一性試験による定期的なモニタリングは不可欠です。
主要な学術ジャーナルにおける投稿時のデータ要求
製品開発だけでなく、学術的な側面からも細胞認証の要求は高まっています。Nature、Science、Cellなどの主要な国際学術ジャーナルや、再生医療関連の専門誌では、論文投稿時に使用した細胞株の認証データを提出することを義務、あるいは強く推奨しています。
これは、誤った細胞株を使用した研究データの再現性が低いことが問題視されたためです。研究開発段階から将来の論文発表や知財化を見据える場合、早期から信頼できる同一性試験のデータを蓄積しておくことが、スムーズな成果発表につながります。
STRプロファイリング試験の原理と具体的な実施手順
それでは、実際にSTRプロファイリング試験はどのように行われるのでしょうか。ここでは、試験の原理から、具体的な解析対象の選定、そしてデータベースとの照合まで、実務的な手順を解説します。
ショートタンデムリピート(STR)領域のPCR増幅と解析
STRプロファイリング試験の第一歩は、対象となる細胞からゲノムDNAを抽出することから始まります。抽出したDNAに対し、特定のSTR領域(遺伝子座)を挟み込むプライマーを用いてPCR(ポリメラーゼ連鎖反応)を行い、該当部分を増幅させます。
増幅されたDNA断片は、キャピラリー電気泳動などの装置を用いてサイズごとに分離・検出されます。STR領域は、数塩基の繰り返し配列から成っており、この繰り返しの回数が個人によって異なります。検出されたピークのパターン(アレル)を数値化し、プロファイルとして取得することで、個体特有の識別情報を得ることができます。
解析対象となる遺伝子座(ローカス)の選定基準
解析を行う際、どの遺伝子座(ローカス)を調べるかが重要になります。国際的な細胞認証の基準(ANSI/ATCC ASN-0002)では、ヒト細胞の認証において最低限解析すべき8つのコアSTRローカス(TH01, TPOX, vWA, CSF1PO, D16S539, D7S820, D13S317, D5S818)と、性別判定のためのアメロゲニン(Amelogenin)が規定されています。
より精度を高めるために、これらに加えてさらに多くのローカス(16ローカスや24ローカスなど)を解析する場合もあります。解析するローカスが多いほど、偶然の一致の確率が天文学的に低くなるため、同一性の証明能力は向上します。
公的データベース(JCRB・ATCC・DSMZ)とのパターン照合
取得したSTRプロファイルは、それ単独では意味を持ちません。公的な細胞バンクが保有するデータベースと照合することで、初めてその細胞が何であるかを同定できます。
主な照合先としては、日本のJCRB細胞バンク(JCRB)、アメリカのATCC、ドイツのDSMZなどが挙げられます。これらの機関は膨大な細胞株のSTRデータを公開しており、自社の細胞の解析結果を検索エンジンに入力することで、登録されている細胞株との一致率を確認できます。自家細胞(患者自身の細胞)を用いる場合は、ドナー本人の組織(血液や口腔粘膜など)から得たプロファイルと比較照合を行います。
ヒト由来細胞以外の場合の種同定試験(CO1解析等)
STR解析は主にヒト細胞の個人識別に用いられる手法ですが、再生医療研究ではマウスやラットなどの動物由来細胞を使用することもあります。しかし、ヒト用のSTRプライマーは動物細胞には反応しない、あるいは特異性が低い場合があります。
ヒト以外の細胞の同一性を確認する場合、あるいは異種細胞の混入(ヒト細胞へのマウス細胞の混入など)を否定したい場合は、CO1(シトクロムcオキシダーゼサブユニット1)遺伝子の解析など、種同定試験を行う必要があります。目的に応じて適切な解析手法を選択しましょう。
同一性試験における判定基準と結果の解釈
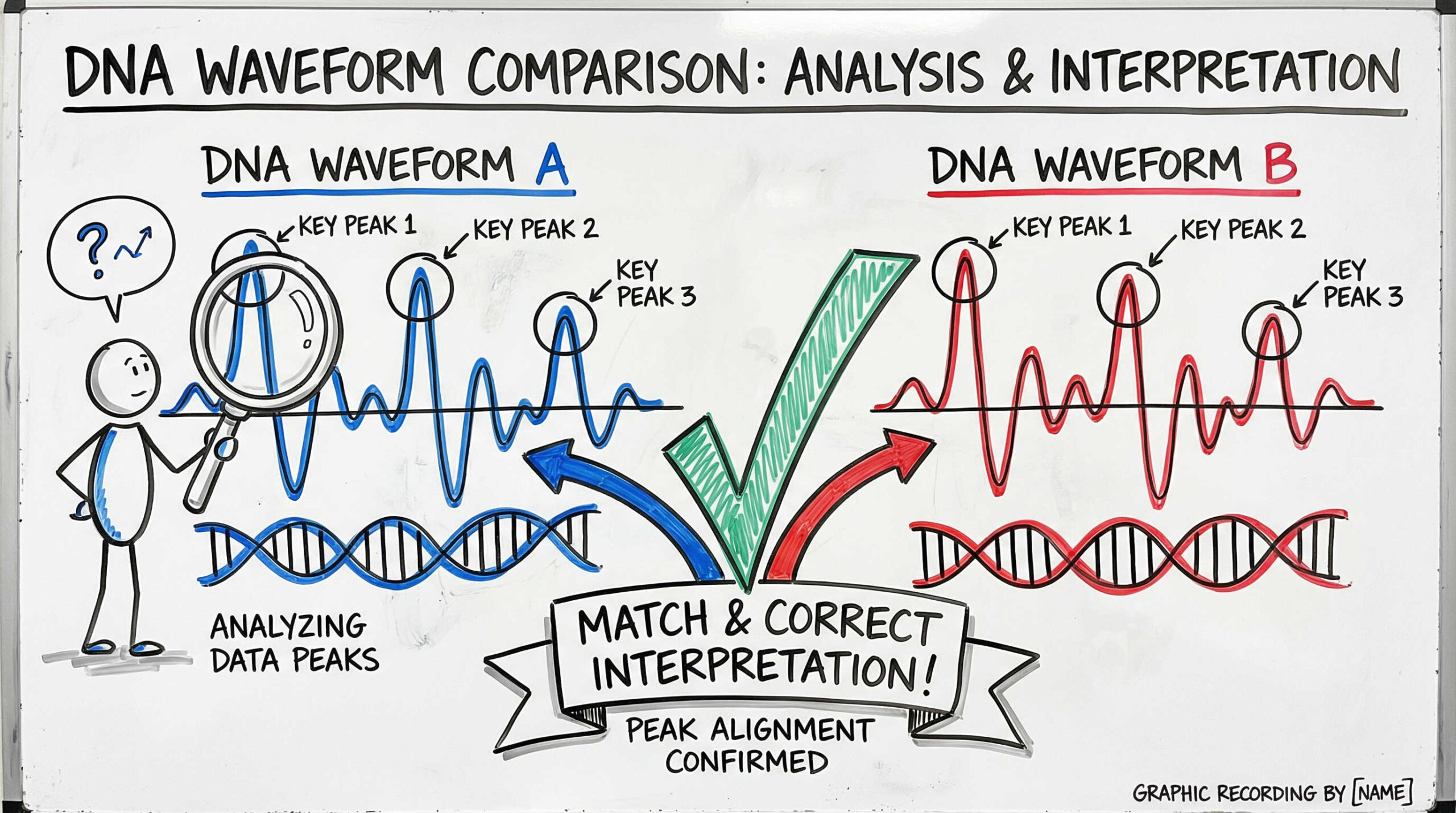
試験を実施した後は、得られたデータに基づいて適切な判断を下す必要があります。数値としての一致率だけでなく、波形の微妙な変化や異常をどう読み解くか、専門的な解釈のポイントをご紹介します。
データベース照合における一致率(マッチング率)の目安
データベースや参照検体(ドナー組織など)と照合した際、どの程度の一致率であれば「同一」とみなせるのでしょうか。一般的な基準(ANSI/ATCC ASN-0002)では、以下のような目安が用いられています。
- 一致率 80%以上: 同一の細胞株であると判定(実質的に同じ由来)
- 一致率 56%〜79%: 関連性がある可能性(さらなる検証が必要)
- 一致率 56%未満: 異なる細胞株(無関係)
ただし、これはあくまで一般的な目安です。再生医療製品の品質管理においては、可能な限り100%に近い一致、あるいは不一致の合理的な説明(継代による微細な変異など)が求められる場合が多いでしょう。
ピークパターンの不一致や異常が見られた場合の対応
期待されるパターンと異なるピークが検出された場合(マルチピークなど)、慎重な対応が必要です。これは、他細胞の混入(クロスコンタミネーション)を示唆している可能性が高いからです。例えば、本来1つか2つのピークしか出ないはずの遺伝子座で、3つ以上のピークが明確に検出された場合は、複数の細胞が混ざっている疑いがあります。
このような異常が見られた場合は、直ちに該当する細胞の使用を停止し、原因究明を行うとともに、汚染されていない初期のストックから再培養を行うなどの対策を講じる必要があります。
遺伝的不安定性(MSI)が疑われるケースの評価
がん細胞株や、長期培養によって遺伝的に不安定になった細胞では、マイクロサテライト不安定性(MSI)と呼ばれる現象が起きることがあります。これは、DNA複製のエラー修復機能の低下により、STR領域の繰り返し回数が変化してしまう現象です。
MSIが生じると、元の細胞と同じ由来であっても、STRプロファイルが微妙に変化し、一致率が低下することがあります。このようなケースでは、単に「不一致」として切り捨てるのではなく、細胞の特性としてMSIが発生しやすいかどうかを考慮し、専門家の意見を交えて総合的に評価することが重要です。
細胞の同一性試験を実施すべき推奨タイミング
細胞の同一性試験は、毎日行うものではありません。コストとリソースを最適化しつつ、リスクを確実に管理するためには、適切なタイミングで実施することが肝要です。ここでは、特に推奨される3つの実施タイミングをご提案します。
マスターセルバンク(MCB)およびワーキングセルバンク(WCB)樹立時
最も重要なタイミングは、製造の元となる「マスターセルバンク(MCB)」および「ワーキングセルバンク(WCB)」を樹立した直後です。
これらは製品製造の源泉となる細胞ストックであり、ここで同一性が保証されていなければ、以降のすべての製造ロットが無駄になってしまいます。MCB/WCBの特性解析の一環としてSTRプロファイリングを行い、そのプロファイルを「基準データ」として保存しておくことが、品質管理の出発点となります。
研究開発から製造部門への技術移管(トランスファー)時
研究室からGMP製造部門への移管、あるいは製造拠点の変更など、技術移管(トランスファー)が行われる際も重要なタイミングです。
扱う担当者や環境が変わることで、取り違えのリスクが高まる可能性があります。移管元の細胞と、移管先で培養・バンク化した細胞のSTRプロファイルを比較し、輸送や操作の過程で細胞が入れ替わっていないことを客観的に証明することで、スムーズな技術移管を支援します。
凍結保存細胞の融解時および培養終了時
長期保存していた細胞を融解して使用を開始する際や、一定期間の培養が終了した時点での確認も推奨されます。
凍結・融解の過程でのトラブルや、長期培養中に意図しない細胞が混入していないかを確認するためです。特に、複数の細胞株を同時に扱う施設では、定期的なモニタリングとして培養終了時のチェックを行うことで、交叉汚染のないクリーンな環境が維持されていることを証明できます。
試験機関の選定と委託・自社実施の比較検討
細胞の同一性試験を実施するには、自社で設備を整えるか、外部の専門機関に委託するかを選択する必要があります。それぞれのメリットと課題を整理し、自社の状況に最適な選択をするための比較検討ポイントを解説します。
専門検査機関へ委託する場合のメリット(第三者性・信頼性)
専門の検査機関へ委託する最大のメリットは、第三者による客観的な証明が得られる点です。自社内でのデータは「手盛り」と見なされるリスクがありますが、認証された機関が発行する報告書は、規制当局や外部への信頼性が非常に高くなります。
また、STR解析には高度な専門知識と経験が必要です。専門機関であれば、データの解析や微妙なピークの判定において、熟練した専門家の知見を活用できるため、結果の確実性が担保されます。
自社で認証キットを使用する場合の課題とコスト
一方、自社でキットを購入して実施する場合、サンプルを外部に出す手間が省け、即座に結果が得られるという利点があります。しかし、導入にはキャピラリー電気泳動装置などの高額な機器投資や、維持管理コストが必要です。
さらに、正確な解析を行うためには担当者のトレーニングが欠かせません。解析頻度が高くない場合、試薬の期限切れやスキルの維持が課題となり、結果として委託よりもコスト高になるケースも少なくありません。
委託先選定のポイント(GLP/GMP対応・ISO認証・実績)
委託先を選定する際は、単に価格だけでなく、品質保証体制を確認することが重要です。再生医療製品の申請用データとして使用する場合、GLP(Good Laboratory Practice)やGMP(Good Manufacturing Practice)に準拠した体制、あるいはISO認証を取得している機関が望ましいでしょう。
また、これまでの解析実績や、異常データが出た際のコンサルティング能力も重要な選定基準です。信頼できるパートナーを選ぶことが、スムーズな開発への近道となります。
まとめ

再生医療製品の品質管理において、細胞の同一性試験(STRプロファイリング等)は、製品の信頼性と患者様の安全を守るための「防波堤」です。
規制当局のガイドライン対応はもちろんのこと、予期せぬ交叉汚染や取り違え事故を防ぐためにも、科学的根拠に基づいた認証プロセスは欠かせません。MCB/WCBの樹立時や技術移管時など、適切なタイミングで試験を実施し、確実なデータを蓄積していくことが大切です。
自社実施と外部委託、それぞれの特性を理解した上で、最適な品質管理フローを構築し、自信を持って社会に送り出せる製品開発を進めていきましょう。
細胞の同一性試験(STRプロファイリング等)についてよくある質問
以下は、細胞の同一性試験に関してよく寄せられる質問とその回答です。
-
STR解析に必要な細胞数やDNA量はどのくらいですか?
- 一般的には、1×10^6個程度の細胞ペレット、または数十ng〜数百ngの精製ゲノムDNAが必要です。試験機関や使用するキットによって推奨量が異なるため、事前に委託先の要件を確認することをお勧めします。
-
ヒト以外の動物細胞でもSTR解析は可能ですか?
- マウスやアフリカミドリザルなど、一部の実験動物ではSTRマーカーが確立されており解析可能です。しかし、ヒトほど一般的ではないため、対応可能な機関が限られます。種同定(CO1解析など)で代用するケースも多いです。
-
試験結果が出るまでの期間(納期)はどのくらいですか?
- 委託機関によりますが、検体受領から通常1〜2週間程度で報告書が納品されることが一般的です。特急対応を行っている機関であれば、数営業日で結果が得られる場合もあります。
-
すでに汚染が疑われる細胞も解析してもらえますか?
- はい、可能です。汚染の有無や、何が混入しているかを特定するためにSTR解析は非常に有効です。ただし、感染性の高いウイルス汚染などが疑われる場合は、受け入れ条件が厳しくなることがあります。
-
海外の規制当局(FDAなど)への申請にも使えますか?
- 国際的な基準(ANSI/ATCC ASN-0002など)に準拠した方法で実施され、信頼できる機関から発行された英文報告書であれば、FDAやEMAなどの海外規制当局への申請資料としても使用可能です。
{
"@context": "https://schema.org",
"@type": "FAQPage",
"mainEntity": [
{
"@type": "Question",
"name": "STR解析に必要な細胞数やDNA量はどのくらいですか?",
"acceptedAnswer": {
"@type": "Answer",
"text": "一般的には、1×10^6個程度の細胞ペレット、または数十ng〜数百ngの精製ゲノムDNAが必要です。試験機関や使用するキットによって推奨量が異なるため、事前に委託先の要件を確認することをお勧めします。"
}
},
{
"@type": "Question",
"name": "ヒト以外の動物細胞でもSTR解析は可能ですか?",
"acceptedAnswer": {
"@type": "Answer",
"text": "マウスやアフリカミドリザルなど、一部の実験動物ではSTRマーカーが確立されており解析可能です。しかし、ヒトほど一般的ではないため、対応可能な機関が限られます。種同定(CO1解析など)で代用するケースも多いです。"
}
},
{
"@type": "Question",
"name": "試験結果が出るまでの期間(納期)はどのくらいですか?",
"acceptedAnswer": {
"@type": "Answer",
"text": "委託機関によりますが、検体受領から通常1〜2週間程度で報告書が納品されることが一般的です。特急対応を行っている機関であれば、数営業日で結果が得られる場合もあります。"
}
},
{
"@type": "Question",
"name": "すでに汚染が疑われる細胞も解析してもらえますか?",
"acceptedAnswer": {
"@type": "Answer",
"text": "はい、可能です。汚染の有無や、何が混入しているかを特定するためにSTR解析は非常に有効です。ただし、感染性の高いウイルス汚染などが疑われる場合は、受け入れ条件が厳しくなることがあります。"
}
},
{
"@type": "Question",
"name": "海外の規制当局(FDAなど)への申請にも使えますか?",
"acceptedAnswer": {
"@type": "Answer",
"text": "国際的な基準(ANSI/ATCC ASN-0002など)に準拠した方法で実施され、信頼できる機関から発行された英文報告書であれば、FDAやEMAなどの海外規制当局への申請資料としても使用可能です。"
}
}
]
}