再生医療等製品の開発において、品質管理担当者を悩ませる大きな課題の一つが、エンドトキシン試験と発熱性物質管理ではないでしょうか。
最終滅菌が困難な細胞製品において、患者様の安全を脅かす発熱性物質(パイロジェン)の混入は、何としても防がなければならない重大なリスクです。
しかし、従来の医薬品とは異なる製品特性や、動物愛護の観点からの試験法改正の動きなど、考慮すべき要素は多岐にわたります。
本記事では、再生医療分野における最新の規制要件に基づき、エンドトキシン試験の実務から、近年注目されるMAT法(モノサイト活性化試験)への移行、そして製造プロセス全体での汚染管理戦略までを網羅的に解説します。
確実な安全性保証体制を構築するための手引きとして、ぜひお役立てください。
再生医療等製品におけるエンドトキシン試験と発熱性物質管理の基本戦略
再生医療等製品は、その特性上、一般的な医薬品とは異なる品質管理戦略が求められます。特に無菌性と発熱性物質の管理は、患者様の安全に直結する最重要項目といえるでしょう。ここでは、規制要件を踏まえた基本的な管理戦略について解説します。
最終滅菌困難な製品特性と無菌性保証の考え方
多くの再生医療等製品は、生きた細胞を含んでいるため、製造後の最終滅菌(オートクレーブやガンマ線滅菌など)を行うことができません。
そのため、製造プロセス全体を通じて無菌性を担保する「無菌操作法」による製造が前提となります。
これは、最終製品での試験だけでなく、原材料の受け入れから製造環境、作業者に至るまで、厳格な管理が必要であることを意味します。
無菌性保証は、単なる試験結果(合格/不合格)ではなく、プロセス全体で積み上げられる信頼性によって成り立つものと理解しましょう。
リスクベースアプローチによる管理基準の設定
すべてのリスクをゼロにすることは現実的ではありません。そこで重要となるのが、リスクベースアプローチによる管理基準の設定です。
ICH Q9(品質リスクマネジメント)のガイドラインなどを参考に、以下の要素を評価します。
- 原材料のリスク: 生物由来原料の使用有無
- プロセスのリスク: 開放系操作の有無や培養期間
- 投与経路のリスク: 静脈内投与か、局所投与か
これらのリスク要因を分析し、科学的根拠に基づいた管理限界値や試験頻度を設定することが、効率的かつ効果的な管理につながります。
GCTP省令および日本薬局方における規制要件の概要
日本国内において、再生医療等製品の品質管理は「GCTP省令(再生医療等製品の製造管理及び品質管理の基準に関する省令)」および「日本薬局方(JP)」に準拠する必要があります。
GCTP省令では、製品の品質を確保するための組織体制や手順書の整備が求められます。
また、日本薬局方には、エンドトキシン試験法や発熱性物質試験法などの具体的な試験方法が収載されており、これらに従った試験実施が基本となります。
規制要件は適宜改正されるため、PMDA(医薬品医療機器総合機構)の発出する通知などを常に注視し、最新の情報をキャッチアップしておくことが大切です。
エンドトキシンと発熱性物質(パイロジェン)の定義と管理上の違い
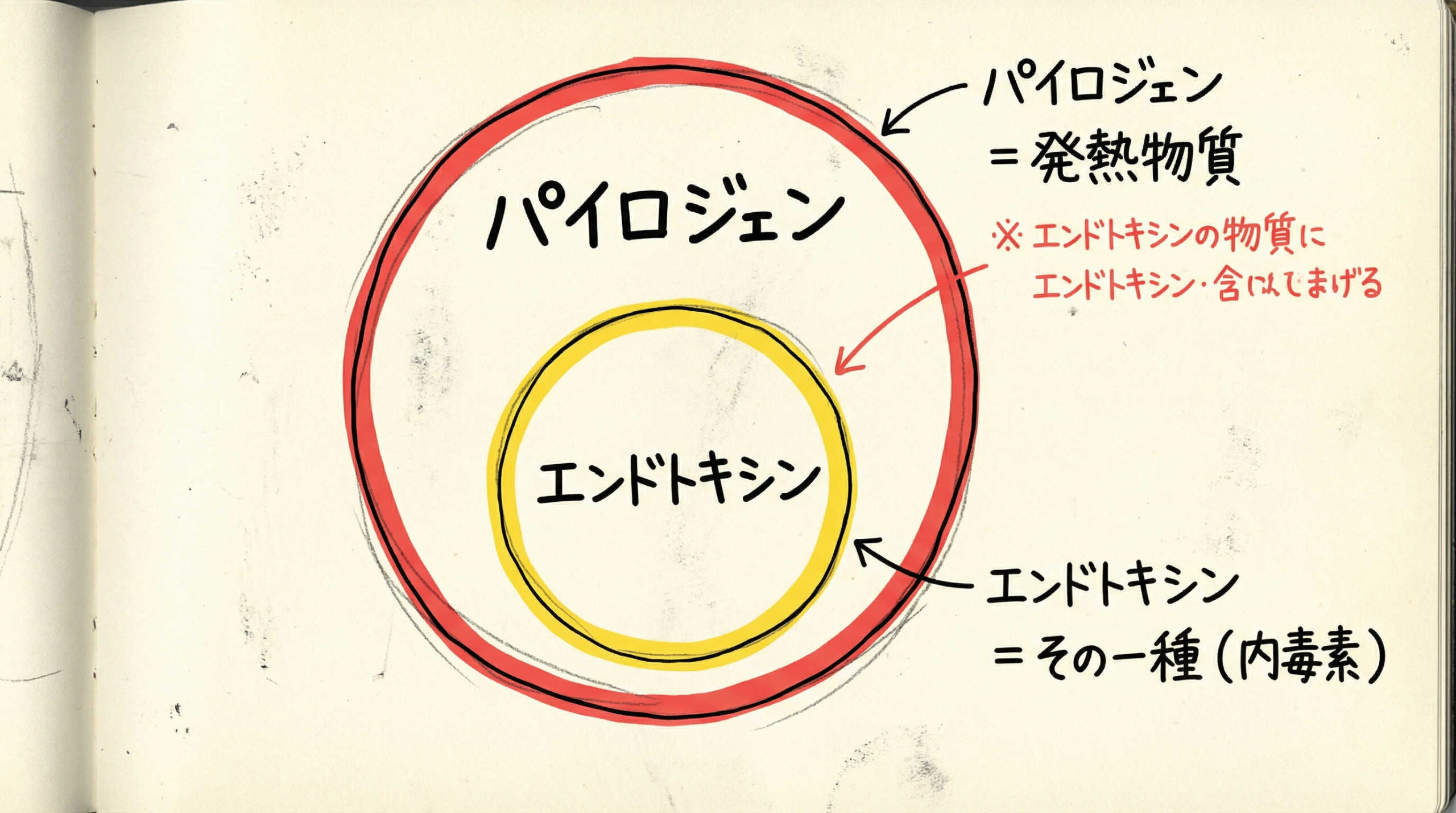
「エンドトキシン」と「発熱性物質(パイロジェン)」は混同されがちですが、厳密には包含関係にあり、管理上のアプローチも異なります。適切な試験法を選定するためには、まずこの両者の定義と違いを正しく理解しておく必要があります。
グラム陰性菌由来のエンドトキシン(LPS)の特性
エンドトキシン(Endotoxin)は、主にグラム陰性菌の細胞壁外膜を構成する「リポ多糖(LPS)」のことを指します。
菌が死滅・破壊された際に放出される毒素であり、ごく微量でもヒトに激しい発熱やショック症状を引き起こす可能性があります。
エンドトキシンの厄介な点は、以下の特性を持っていることです。
- 耐熱性: 通常の加熱滅菌では不活化されにくい
- 安定性: 環境中で長期間残存する
- 除去困難: フィルターを通過することがある
したがって、菌そのものを除去するだけでなく、エンドトキシンの混入を防ぐための特化した対策が不可欠です。
エンドトキシン以外の発熱性物質(Non-endotoxin pyrogens)
発熱性物質(パイロジェン)は、生体に発熱を引き起こす物質の総称です。エンドトキシンは代表的なパイロジェンですが、それだけではありません。
「エンドトキシン以外の発熱性物質(Non-endotoxin pyrogens: NEP)」には、以下のようなものが含まれます。
- グラム陽性菌由来物質: ペプチドグリカン、リポテイコ酸など
- ウイルス、真菌: これら自体やその構成成分
- 化学物質: 薬剤や材料由来の化学的パイロジェン
従来のエンドトキシン試験(LAL法)では、グラム陰性菌由来のエンドトキシンしか検出できません。NEPのリスクがある場合は、別の管理手法が必要となります。
安全性評価における両者の試験区分の必要性
再生医療等製品の安全性評価においては、製品の特性や製造工程のリスクに応じて、エンドトキシン試験と広義の発熱性物質試験を使い分ける、あるいは組み合わせる必要があります。
一般的に、細菌汚染のリスク管理としてはエンドトキシン試験が第一選択となります。
しかし、原材料にグラム陽性菌由来成分が含まれる場合や、製造工程でNEP混入のリスクが否定できない場合は、エンドトキシン試験だけでは安全性を保証できません。
このようなケースでは、後述するMAT法(モノサイト活性化試験)など、NEPも検出可能な試験系の導入を検討する必要があるでしょう。
日本薬局方に準拠したエンドトキシン試験法の選定と実施実務
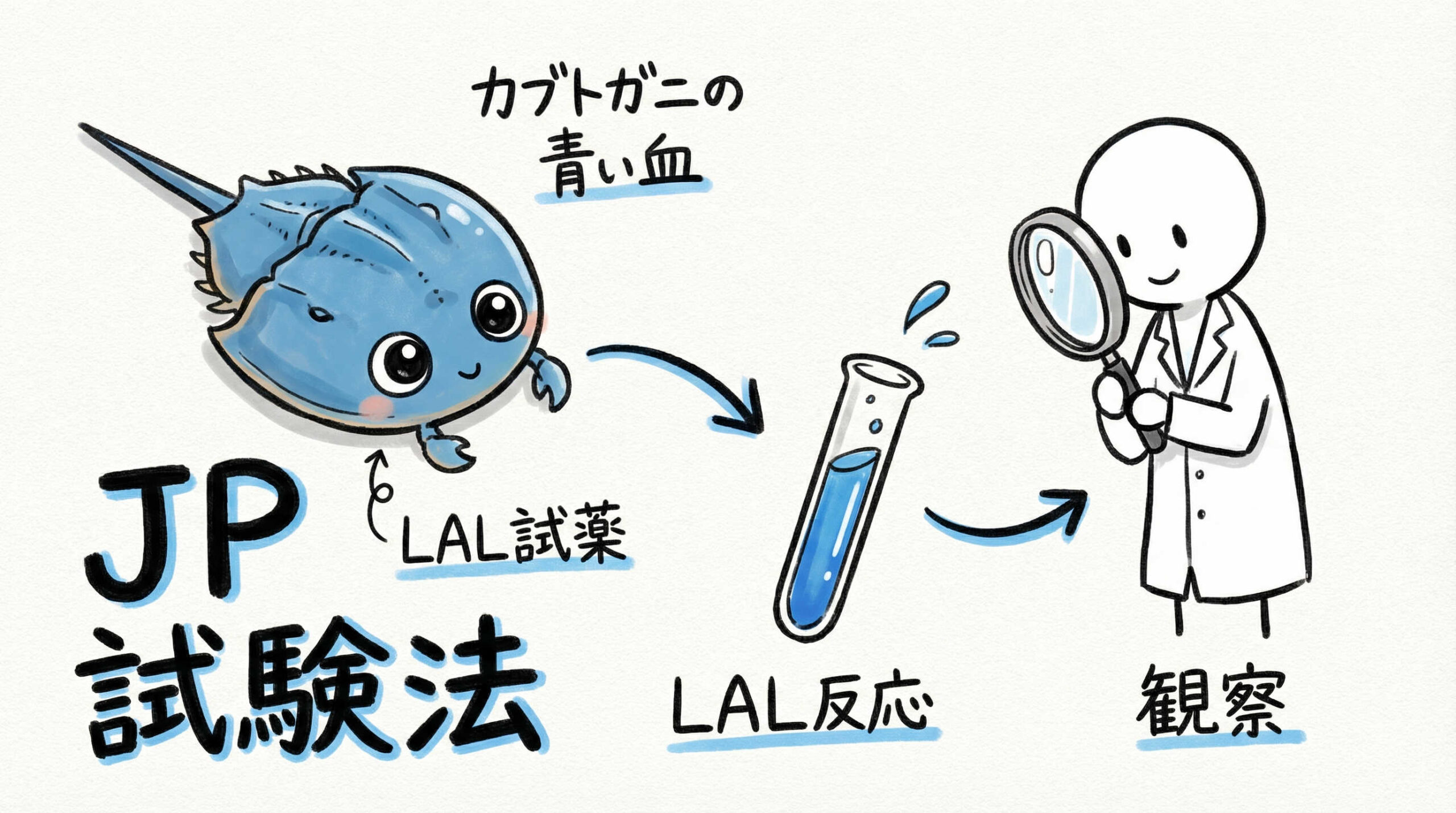
日本薬局方(JP)に収載されているエンドトキシン試験法は、カブトガニの血球抽出成分(LAL試薬)を用いた試験法が標準的です。ここでは、試験法の原理や細胞製品特有の課題である反応干渉への対策など、実務的なポイントを解説します。
ゲル化法・比濁法・比色法の原理と使い分け
LAL試薬を用いたエンドトキシン試験には、主に以下の3つの測定法があり、それぞれの特徴に応じて使い分けます。
| 測定法 | 原理 | 特徴 | 適した用途 |
|---|---|---|---|
| ゲル化法 | ゲル形成の有無を目視判定 | 簡便、安価、定性判定 | 限度試験、予備試験 |
| 比濁法 | ゲル形成に伴う濁度変化を測定 | 高感度、定量的 | 経時的な工程管理 |
| 比色法 | 発色合成基質の分解による発色を測定 | 特異性が高い、高感度 | 着色検体、微量検体 |
再生医療等製品では、検体量が限られることが多いため、微量で測定可能な比色法や比濁法(カイネティック法)が選択される傾向にあります。
細胞製品特有の反応干渉因子とその除去・補正方法
細胞製品の試験において最大の壁となるのが「反応干渉」です。
培地に含まれる成分(タンパク質、電解質など)や、細胞そのものがLAL反応を阻害したり、逆に促進(偽陽性)したりすることがあります。
これを回避するためには、必ず「反応干渉因子試験」を実施し、干渉作用の有無を確認しなければなりません。
干渉が認められた場合は、以下の方法で除去・補正を試みます。
- 希釈: 干渉作用がなくなるまで検体を希釈する(MVDの範囲内で)
- 加熱: 不要なタンパク質を変性させる
- 中和・透析: pH調整や緩衝液の使用
適切な前処理条件を見つけ出すことが、正確な測定への第一歩です。
検体前処理における希釈倍率と最大有効希釈倍率(MVD)の設定
反応干渉を回避するために検体を希釈する場合、どこまで薄めてよいかという限界値があります。これを「最大有効希釈倍率(MVD: Maximum Valid Dilution)」と呼びます。
MVDは以下の式で算出されます。
MVD = (エンドトキシン規格値 × 検体濃度) / ライセート試薬の検出限界
希釈倍率がMVDを超えてしまうと、規格値レベルのエンドトキシンが含まれていても検出できなくなってしまいます。
したがって、使用する試薬の感度と製品の規格値を考慮し、MVDの範囲内で、かつ反応干渉の影響を受けない最適な希釈倍率を設定することが重要です。
代替法としての遺伝子組換え試薬(rFC法)の活用可能性
近年、カブトガニの保護や試薬のロット間差低減の観点から、遺伝子組換え技術を用いた「rFC(Recombinant Factor C)試薬」の活用が進んでいます。
rFC法は、エンドトキシンに対する特異性が高く、従来のLAL法で問題となりがちなβ-グルカンによる偽陽性の影響を受けにくいという利点があります。
日本薬局方においても代替法としての位置づけが議論されており、欧米ではすでに公定法として採用される動きがあります。
導入にあたっては、従来法との同等性評価やバリデーションが必要となりますが、持続可能な試験法として有力な選択肢となるでしょう。
発熱性物質試験の最新潮流:ウサギ発熱性物質試験からMAT法への移行
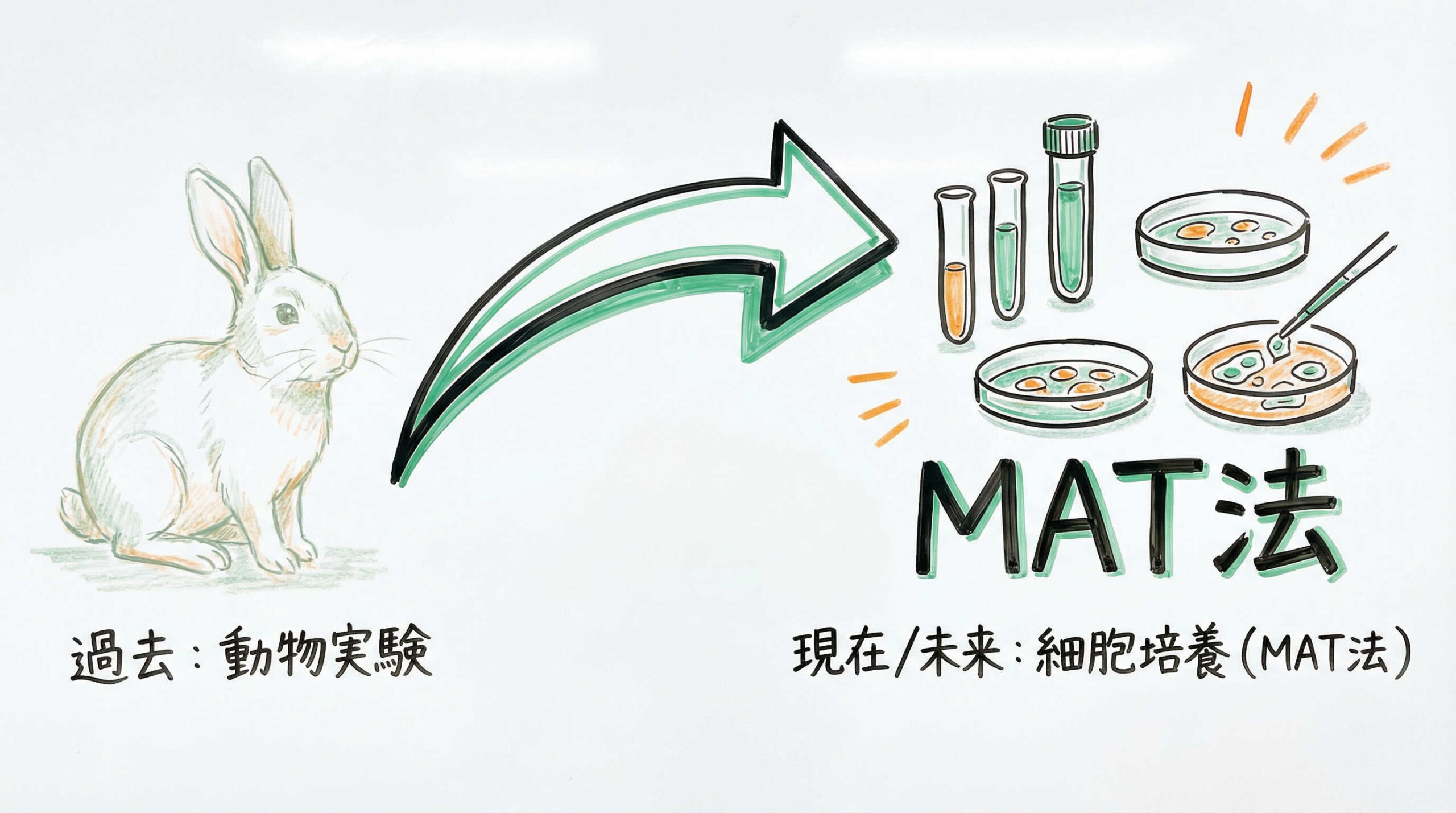
長らく発熱性物質の検出にはウサギを用いた試験が行われてきましたが、世界的な動物愛護の潮流により、In vitro(試験管内)試験であるMAT法への移行が加速しています。ここでは、このパラダイムシフトの背景とMAT法の実際について掘り下げます。
動物愛護(3Rs)の観点と規制当局による試験法改正の動向
医薬品開発において「3Rsの原則(Replacement: 代替、Reduction: 削減、Refinement: 苦痛軽減)」は避けて通れないテーマです。
これを受け、欧州薬局方(EP)ではウサギ発熱性物質試験を削除し、代替法へ完全移行する方針が打ち出されています。
日本国内でもこの流れは同様であり、可能な限り動物実験を行わない代替法への切り替えが推奨されています。
再生医療等製品においても、倫理的な観点および科学的な妥当性の観点から、開発初期段階で動物を用いない試験法の採用を検討することがスタンダードになりつつあります。
モノサイト活性化試験(MAT)の原理と導入メリット
モノサイト活性化試験(MAT: Monocyte Activation Test)は、ヒトの血液(または単球系細胞株)に検体を添加し、免疫反応によって放出されるサイトカイン(IL-6, IL-1βなど)を測定する方法です。
MAT法の導入には以下の大きなメリットがあります。
- ヒト反応の模倣: ウサギよりもヒトの発熱反応を正確に反映できる
- NEPの検出: エンドトキシン以外の発熱性物質も検出可能
- 高感度: ウサギ試験よりも低い検出限界を設定可能
特に、LAL法では検出できない汚染リスクをカバーできる点は、安全性の観点から非常に有益です。
再生医療等製品におけるMAT法適用時のバリデーション項目
MAT法を再生医療等製品に適用する場合、製品自体が免疫反応を刺激したり、サイトカインを含んでいたりする可能性があるため、バリデーションが複雑になることがあります。
主な検討項目は以下の通りです。
- 検出限界(LOD): 目的とする感度が得られるか
- 妨害因子の確認: 製品成分がサイトカイン産生や測定系に影響しないか
- 特異性: 発熱性物質に対して特異的に反応するか
特に細胞製品の場合、製品由来のサイトカインがバックグラウンド値を上昇させることがあるため、適切な陰性対照の設定や洗浄操作などの工夫が求められます。
製品開発段階における試験法変更のタイミングと戦略
試験法の変更は、開発ステージが進むほどコストと労力がかかります。
承認申請直前になってMAT法への切り替えを求められると、データの取り直しなどで開発スケジュールに遅れが生じるリスクがあります。
そのため、研究開発の早期段階からMAT法の適用可能性を検討し、LAL法との比較データを蓄積しておく戦略が有効です。
「将来的にMAT法が主流になる」という前提で、試験法の選定とバリデーション計画を立てておくことが、スムーズな承認取得への近道となるでしょう。
製造プロセス全体における発熱性物質の混入防止と汚染管理戦略
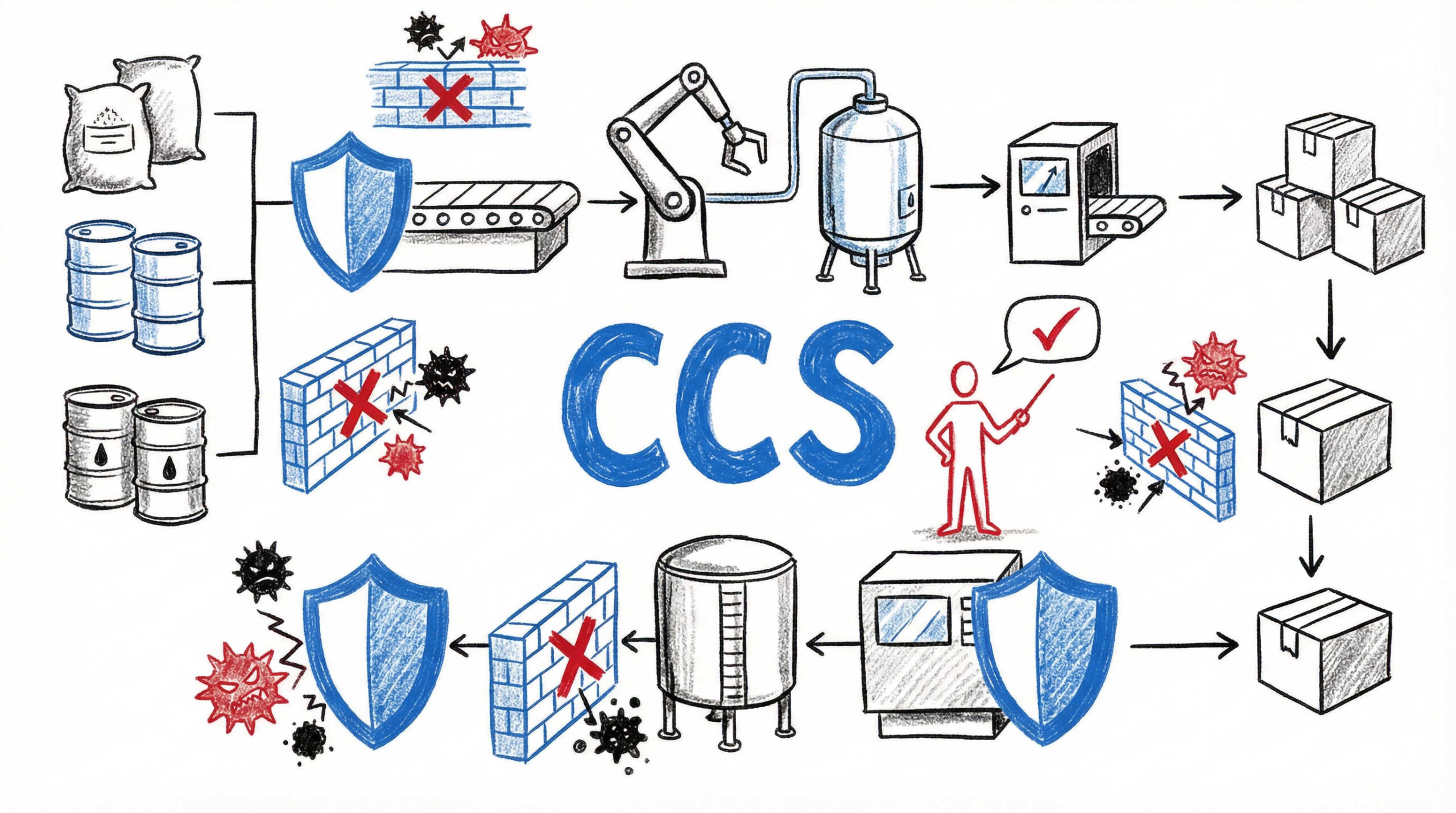
試験はあくまで確認手段であり、品質は製造プロセスの中で作り込むものです。エンドトキシンや発熱性物質の混入を防ぐためには、汚染管理戦略(CCS: Contamination Control Strategy)の構築が不可欠です。製造現場での具体的な管理ポイントを見ていきましょう。
原材料・培地・添加剤の品質評価と受入試験基準
「Garbage In, Garbage Out(質の悪いものを入れれば、質の悪い製品ができる)」の原則通り、原材料の品質は最終製品の安全性に直結します。
培地、血清、成長因子などの原材料については、メーカーから試験成績書(CoA)を入手し、エンドトキシン規格が適切に設定されているかを確認します。
また、重要原材料については、自社でも受け入れ試験を行い、ロットごとの変動をモニタリングすることが推奨されます。
特に生物由来原料は汚染リスクが高いため、ウイルス安全性やマイコプラズマ否定試験と合わせて、厳格な管理基準を設ける必要があります。
製造設備および消耗品(シングルユース製品)からの溶出リスク管理
再生医療の製造では、クロスコンタミネーション防止のためにシングルユース製品(バッグ、チューブ、コネクタ等)が多用されます。
便利な反面、これらのプラスチック部材からエンドトキシンや化学物質が溶出するリスクも考慮しなければなりません。
サプライヤー選定時には、製造工程でのエンドトキシン管理状況や、部材からの溶出物試験データを確認しましょう。
また、使用前に洗浄(リンス)を行うことで、初期溶出物を低減させる手順を組み込むことも、リスク低減策として有効です。
洗浄バリデーションにおけるエンドトキシン除去の評価
マルチユース(再使用可能)の製造機器や器具を使用する場合、洗浄プロセスのバリデーションにおいてエンドトキシン除去性能を評価することが重要です。
洗浄後のリンス水(最終洗浄水)を採取し、エンドトキシン試験を実施して、残留レベルが許容値以下であることを確認します。
- 洗浄剤の選定
- 洗浄温度と時間
- 乾燥・保管方法
これらが適切に設定・維持されていないと、湿潤環境下で菌が増殖し、エンドトキシン汚染の原因となります。定期的かつ厳格な検証を行いましょう。
製造環境モニタリングと作業者由来の汚染防止策
エンドトキシン汚染の最大の発生源の一つは「水」であり、次いで「ヒト」です。
製造用水の管理はもちろんのこと、作業者からの汚染を防ぐための対策が欠かせません。
- 更衣(ガウニング): 無菌衣の適切な着用と管理
- 手指衛生: 手袋の消毒手順の徹底
- 動作: 発塵を抑える緩やかな動作
また、環境モニタリングにより、製造エリアの清浄度を常時監視し、アラートレベルを超えた場合は即座に原因究明と是正措置を行う体制を整えておくことが、汚染防止の要となります。
まとめ
再生医療等製品におけるエンドトキシン試験と発熱性物質管理は、患者様の命を守るための最後の砦です。
最終滅菌ができないという製品特性上、原材料の選定から製造環境の整備、そして最新の規制要件に適合した試験法の実施に至るまで、一貫した汚染管理戦略(CCS)が求められます。
特に、動物愛護の観点からのMAT法への移行や、rFC法のような新技術の導入は、今後の業界標準となっていくでしょう。
現状の試験法に満足することなく、常に「より高い安全性」と「合理的な管理」を追求し続ける姿勢が、信頼される製品開発の鍵となります。
本記事が、貴社の品質管理体制の構築と強化の一助となれば幸いです。
エンドトキシン試験と発熱性物質管理についてよくある質問

ここでは、エンドトキシン試験と発熱性物質管理に関して、実務担当者からよく寄せられる質問をまとめました。