再生医療等製品の実用化が進む中で、その品質を担保するための評価手法として「フローサイトメトリー(FCM)」の重要性がますます高まっています。細胞という生きた製剤を扱う現場において、製品の均一性や有効性を科学的に証明することは、規制要件を満たす上で避けては通れない課題です。
特に、細胞表面マーカーを用いた特性解析や純度試験は、製品の安全性と有効性を直接的に示す重要な指標となります。しかし、フローサイトメトリーは測定者の手技や解析設定によって結果が変動しやすく、堅牢な試験法を確立するには専門的な知識と経験が求められます。
本記事では、再生医療製品の研究開発や品質管理に携わる皆様に向けて、フローサイトメトリーを用いた細胞品質評価の具体的な手法から、ICH Q2ガイドラインに準拠した分析法バリデーションのポイント、さらには測定の信頼性を高めるためのノウハウまでを網羅的に解説します。確実な品質管理体制の構築にお役立てください。
フローサイトメトリーは再生医療製品の品質管理における特性解析・純度試験の要
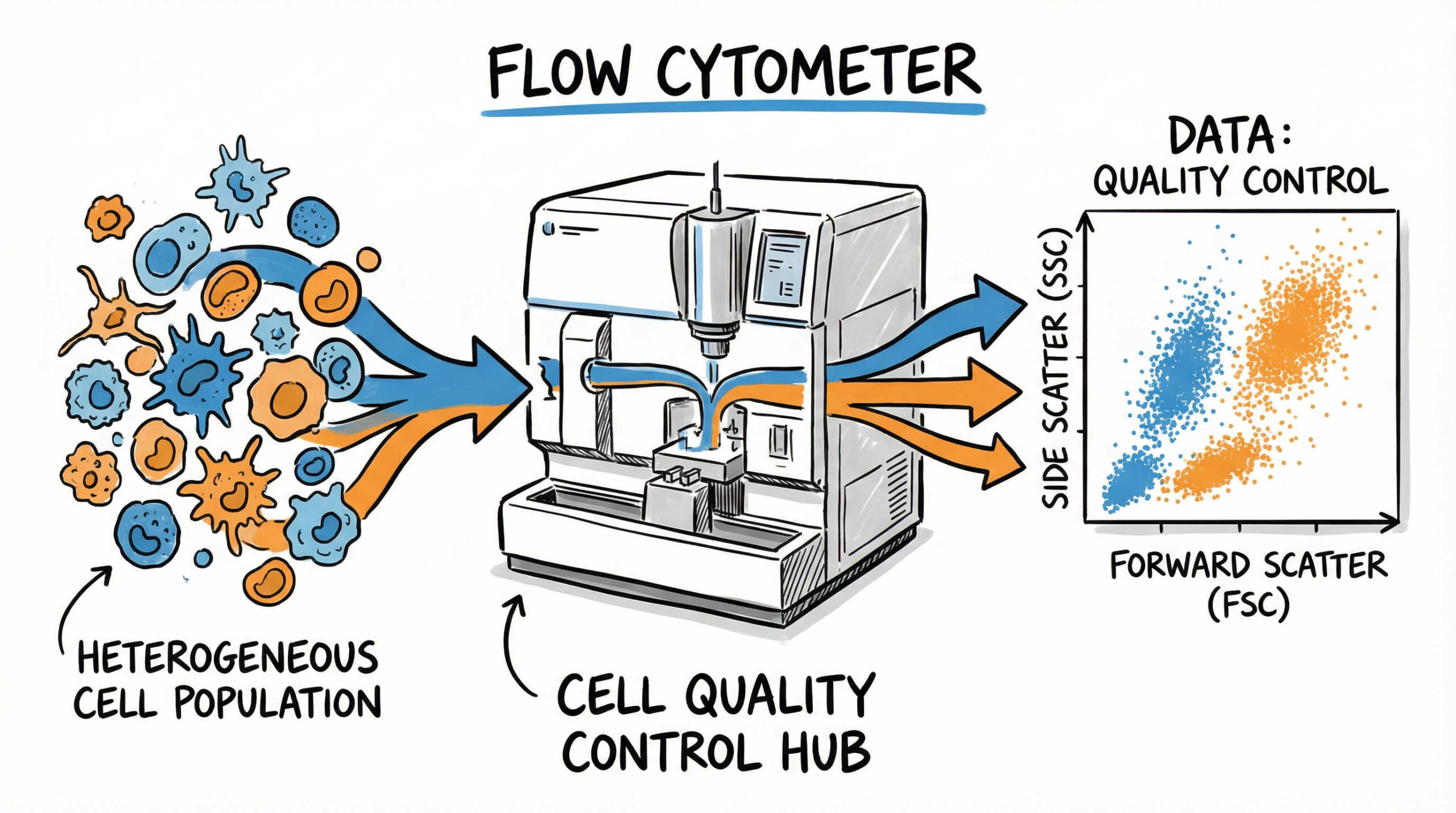
フローサイトメトリーは、レーザー光を用いて個々の細胞が持つ散乱光や蛍光シグナルを高速かつ多パラメータで解析する技術であり、再生医療製品の品質管理(QC)において中心的な役割を果たしています。細胞加工製品は、低分子医薬品とは異なり、その構成成分が複雑で不均一な「細胞集団」です。そのため、製品全体の平均値を測るだけでは不十分であり、個々の細胞レベルで特性を把握できるフローサイトメトリーによる解析が欠かせません。
具体的には、目的とする細胞が正しく含まれているかを確認する「特性解析(確認試験)」や、目的外の細胞や不純物が混入していないかを調べる「純度試験」において、その威力を発揮します。規制当局が求める厳格な品質基準(規格値)への適合性を証明するためには、科学的妥当性のあるフローサイトメトリー試験法の確立が、製品開発の成否を分ける鍵となるといえるでしょう。
再生医療等製品の品質評価においてフローサイトメトリーが重要視される背景
再生医療等製品の開発において、なぜこれほどまでにフローサイトメトリーによる評価が重視されているのでしょうか。それは、細胞製剤の品質特性を定量的かつ網羅的に把握するために、現時点で最も適したツールであるからです。ここでは、法規制の観点や技術的な優位性の面から、その重要性が高まっている背景を詳しく見ていきましょう。
GCTP省令および関連ガイドラインにおける細胞特性解析の位置づけ
再生医療等製品の製造管理および品質管理の基準に関する省令(GCTP省令)や関連ガイドラインでは、最終製品の恒常性を担保するために、適切な特性解析を行うことが求められています。細胞はその製造プロセスや培養条件によって形質が変化しやすいため、ロットごとに一定の品質が保たれているかを厳密に管理する必要があります。
フローサイトメトリーは、細胞表面抗原(CDマーカー)の発現パターンを解析することで、その細胞が「何であるか(同一性)」や「どのような状態にあるか」を客観的な数値として示すことが可能です。規制当局への承認申請においても、フローサイトメトリーで得られたデータは、製品の品質を保証する基盤データとして極めて重要な位置づけとなります。
複数の表面抗原マーカーによる細胞集団の定量的評価の必要性
細胞の特性を正確に評価するためには、単一のマーカーだけでなく、複数のマーカーを組み合わせて解析する必要があります。例えば、間葉系幹細胞(MSC)であれば、CD73、CD90、CD105が陽性であり、かつCD34、CD45などが陰性であることを同時に証明することが一般的です。
フローサイトメトリーによるマルチカラー解析を用いれば、一つの細胞上で複数の抗原が共発現しているかどうかを瞬時に判断できます。これにより、目的とする細胞集団の純度(%)や、特定の分化段階にある細胞の割合を定量的に算出することが可能となり、製品の品質特性をより詳細に定義できるのです。
顕微鏡観察や遺伝子発現解析と比較した際のFACS解析の優位性
細胞の評価手法には顕微鏡観察やPCR法などもありますが、フローサイトメトリー(FACS解析)にはこれらとは異なる大きな利点があります。顕微鏡観察は形態情報の取得に優れていますが、数万個単位の細胞を統計的に解析するには不向きです。また、PCR法などの遺伝子発現解析は感度が高いものの、集団全体の平均値となってしまい、ごく少数の不純物細胞の存在を見落とすリスクがあります。
対してフローサイトメトリーは、数万から数百万個の細胞を1個ずつ解析するため、集団内のマイナーポピュレーション(少数派の細胞)を高感度に検出できます。この「シングルセルレベルでの統計的信頼性」こそが、品質評価において選ばれる最大の理由です。
フローサイトメトリーを用いた具体的な品質評価項目と重要品質特性(CQA)
品質管理の現場では、フローサイトメトリーを用いて具体的にどのような項目を測定すべきなのでしょうか。重要品質特性(CQA:Critical Quality Attributes)として設定されることが多い代表的な試験項目について解説します。これらの項目は、製品の安全性や有効性に直結するため、適切な測定系の構築が不可欠です。
特性解析(確認試験):陽性マーカーおよび陰性マーカーの発現確認
特性解析、すなわち確認試験では、その細胞が目的とする細胞種であることを証明します。一般的には、目的細胞に発現しているはずの「陽性マーカー」と、発現していてはならない「陰性マーカー」の組み合わせで評価を行います。
- 陽性マーカー: 細胞の同一性を担保する指標(例:MSCにおけるCD90, CD105など)
- 陰性マーカー: 混入が懸念される他種細胞を否定する指標(例:血液細胞マーカーであるCD45など)
これらを組み合わせたパネルを設定し、陽性率が規格値(例:95%以上)を満たしているか、あるいは陰性率が基準内(例:2%以下)であるかを確認します。
純度試験:未分化細胞や不純物(目的外細胞)の混入否定
純度試験は、製品の安全性に関わる極めて重要な項目です。特にiPS細胞やES細胞などの多能性幹細胞由来の製品では、未分化な細胞が残存していると造腫瘍性(腫瘍形成)のリスクにつながります。
フローサイトメトリーを用いて、Tra-1-60やSSEA-4といった未分化マーカーを発現する細胞が検出限界以下であること、あるいは許容限度値以下であることを証明します。また、製造工程で使用したフィーダー細胞などの不純物が除去されていることを確認するためにも用いられます。ここでは、非常に低い頻度の細胞を正確に検出する高い感度が求められます。
力価試験(ポテンシー):細胞内サイトカイン産生や活性化マーカーの評価
細胞製剤が体内で期待される治療効果を発揮できるかを示すのが「力価(ポテンシー)」です。CAR-T細胞療法などでは、標的抗原に対する反応性や、細胞傷害活性が重要な指標となります。
フローサイトメトリーを用いて、以下のような機能的な指標を評価します。
- サイトカイン産生: インターフェロンガンマ(IFN-γ)やTNF-αなどの細胞内サイトカイン染色
- 活性化マーカー: CD69やCD25などの発現上昇
これらを測定することで、細胞が「生きている」だけでなく「機能する」状態にあることを定量的に評価できるのです。
生存率測定:7-AADやPIを用いた生死判定と細胞数計測
細胞の生存率は、製品の品質における最も基本的なパラメータの一つです。死細胞の割合が高いと、有効成分が少ないだけでなく、死細胞から放出される因子が副作用の原因となる可能性もあります。
従来のトリパンブルー染色法に加え、フローサイトメトリーでは7-AADやPropidium Iodide (PI) といった核酸染色試薬を用いることで、より客観的かつ大量の細胞数に基づいた生死判定が可能です。また、絶対数計測用ビーズを併用することで、生細胞の「濃度(cells/mL)」も同時に算出でき、投与量の決定に役立ちます。
規制要件を満たすための分析法バリデーション実施手順(ICH Q2準拠)
確立した試験法が、品質管理試験として適正であることを科学的に証明するプロセスが「分析法バリデーション」です。再生医療等製品においても、ICH Q2(医薬品規制調和国際会議)ガイドラインに基づいた実施が求められます。ここでは、フローサイトメトリー特有の事情を考慮したバリデーションパラメータの評価手順について解説します。
特異性(Specificity):目的細胞と不純物を明確に識別する能力の検証
特異性とは、不純物や共存物質が存在する中で、測定対象(目的細胞)を正確に識別・測定できる能力のことです。フローサイトメトリーにおいては、目的の蛍光シグナルがバックグラウンドや非特異的結合と区別されていることを示します。
具体的には、アイソタイプコントロールやブロッキング試薬を用いて非特異反応を排除し、陽性細胞集団と陰性細胞集団が明確に分離できていることをヒストグラムやドットプロット上で確認します。また、意図的に他種細胞を混入させた検体を測定し、それらが適切に除外されることを検証する場合もあります。
直線性(Linearity)と範囲(Range):細胞数や陽性率の測定可能範囲の設定
試験法が、ある範囲内で検体中の細胞数や陽性率に対して直線的な測定値を与えるかを確認します。定量的な試験においては必須の項目です。
- 直線性: 段階希釈した細胞懸濁液や、既知の陽性率になるよう混合したサンプルを測定し、理論値と実測値の相関係数(R²)を算出します。
- 範囲: 直線性が確認された領域に基づき、適切な精度と真度をもって測定可能な上限と下限を設定します。
これにより、どの程度の細胞濃度や陽性率までなら信頼できるデータが得られるかを定義します。
真度(Accuracy):既知の標準試料を用いた測定値の正確性確認
真度とは、測定値が真の値にどれだけ近いかを示す指標です。しかし、細胞解析においては「真の値」を定義することが難しい場合が多々あります。
一般的には、認証標準物質(リファレンスマテリアル)があればそれを使用しますが、入手困難な場合は代替法を用います。例えば、純度が高いことが分かっている細胞集団に、既知の割合でターゲット細胞を添加(スパイク)し、その回収率を算出する方法などがとられます。測定結果に偏り(バイアス)がないことを確認する重要な工程です。
併行精度(Repeatability):同一検体・同一条件での測定再現性の確保
併行精度は、同一の検体、同一の試験者、同一の装置を用いて、短期間に繰り返し測定した際の精度のことです。測定系の基本的な安定性を示します。
通常、均一な細胞検体を準備し、少なくとも3回以上(多くは6回程度)連続して測定を行います。得られた陽性率や蛍光強度(MFI)の標準偏差(SD)および変動係数(CV%)を算出し、予め設定した基準値(例:CV < 5%など)以内であることを確認します。ここでのばらつきが大きい場合、手技や機器の状態を見直す必要があります。
室内再現精度(Intermediate Precision):異なる測定日・測定者間でのばらつき評価
実際の品質管理業務では、日によって測定者が変わったり、測定日が異なったりします。室内再現精度では、これらの変動要因があっても結果が安定しているかを評価します。
「異なる測定日」「異なる測定者」「異なる機器(複数台ある場合)」で同一検体(または同一ロットの凍結保存検体)を測定し、その分散分析を行います。この検証を通じて、誰がいつ測定しても同等の結果が得られる試験法であることを保証し、SOP(標準作業手順書)の堅牢性を裏付けます。
頑健性(Robustness):試薬ロットや処理時間の変動が結果に与える影響の評価
頑健性は、試験条件を意図的にわずかに変動させた際に、解析結果が影響を受けないことを示す指標です。日常の試験で起こりうる微細な変化に対する信頼性を評価します。
フローサイトメトリーにおいては、以下のような条件を変動させて検証します。
- 染色時間の長短(例:規定30分に対し、25分と35分)
- 試薬のロット変更
- 測定までの放置時間
これらの変動があっても結果が規格内に収まることを確認しておくことで、実運用時のトラブルを未然に防ぐことができます。
データの信頼性を担保するための測定条件設定と標準化のポイント
バリデーションされた試験法であっても、日々の測定条件がずれていては信頼できるデータは得られません。特にフローサイトメーターは光学系や流路系を持つ精密機器であり、厳密な管理が必要です。ここでは、データの信頼性を恒常的に担保するために、実務レベルで押さえておくべき測定条件設定と標準化のポイントを紹介します。
機器の適格性評価(IQ/OQ/PQ)と日常点検(QCビーズ)の実施
機器自体が正常に動作していることを保証するために、適格性評価(IQ/OQ/PQ)の実施は前提条件となります。導入時の据付時適格性確認(IQ)や運転時適格性確認(OQ)に加え、定期的な性能適格性確認(PQ)が重要です。
日常的には、測定開始前に必ずQCビーズ(品質管理用ビーズ)を用いた点検を行います。レーザーの光軸調整、流路の安定性、検出器の感度が基準範囲内にあることを確認し、日々の機器パフォーマンスの履歴を記録・管理しましょう。これにより、データの経時的なズレを防ぐことができます。
解析におけるゲーティング戦略(Gating Strategy)の客観的設定
フローサイトメトリー解析で最も主観が入りやすいのが「ゲーティング(領域設定)」です。どの細胞集団を解析対象とするかによって、結果の数値が大きく変わってしまいます。
データの客観性を保つためには、SOPにおいてゲーティング手順を明確に定義する必要があります。「FSC/SSCでのデブリ除去」→「ダブレット排除」→「死細胞除去」といった基本フローを固定し、各ゲートの位置設定の根拠(コントロール検体の使用など)を明確にルール化することが求められます。
アイソタイプコントロールおよびFMOコントロールの適切な運用
陽性・陰性の境界線を正しく引くためには、適切なコントロールの設定が欠かせません。
- アイソタイプコントロール: 抗体の非特異的結合量を評価するために使用しますが、近年ではその限界も指摘されています。
- FMO (Fluorescence Minus One) コントロール: マルチカラー解析において、特定の1色だけを抜いた染色を行い、他の蛍光色素からの漏れ込み(スピルオーバー)の影響を厳密に評価してゲートを設定する方法です。
特に多色解析の場合は、FMOコントロールを用いることで、より科学的妥当性の高いゲーティングが可能になります。
マルチカラー解析における蛍光補正(コンペンーセーション)の最適化
複数の蛍光色素を同時に使用する場合、各色素の蛍光スペクトルが重なり合い、他の検出器に漏れ込む現象が起きます。これを電気的に補正するのが「蛍光補正(コンペンーセーション)」です。
適切な補正が行われていないと、偽陽性や偽陰性の原因となります。自動補正機能を持つソフトウェアも増えていますが、最終的には補正用ビーズ(CompBeads)などを用いて単染色コントロールを測定し、補正マトリックスが正しく計算されているかを目視でも確認することが重要です。
抗体の滴定(Titration)とパネルデザインの妥当性確認
抗体の濃度は濃ければ良いというものではありません。過剰な抗体は非特異的結合を増加させ、バックグラウンドを高めてしまいます。逆に薄すぎるとシグナルを検出できません。
正式な試験に使用する前に、抗体の「滴定(Titration)」を行い、S/N比(シグナル対ノイズ比)が最大になる最適な抗体濃度(飽和濃度)を決定しましょう。また、蛍光強度の強い色素を低発現マーカーに割り当てるなど、パネルデザインを工夫することも、高精度なデータを取得するためのコツです。
細胞製造プロセスにおける検体調製時の注意点とトラブルシューティング

測定機器や解析設定が完璧でも、肝心の「細胞(検体)」の状態が悪ければ、正しい評価は行えません。特に接着細胞を剥離して懸濁液にするプロセスは、細胞にストレスを与え、解析結果にアーティファクト(人為的影響)を生じさせる要因となります。ここでは、検体調製時に陥りやすいトラブルとその対策について解説します。
酵素処理による表面抗原のエピトープ消失リスクへの対策
接着細胞を回収する際、トリプシンなどのタンパク質分解酵素を使用するのが一般的ですが、処理時間が長すぎたり濃度が高すぎたりすると、解析対象である細胞表面抗原(エピトープ)まで消化してしまうリスクがあります。
特定のCDマーカーの検出感度が低いと感じた場合は、酵素処理の影響を疑いましょう。対策として、よりマイルドな剥離剤(AccutaseやTrypLE Selectなど)への変更を検討するか、酵素処理後の回復培養時間を設けるなどの工夫が必要です。予備試験で抗原性が保持される条件を確認しておくことを推奨します。
細胞凝集(ダブレット)の排除と単一細胞浮遊液の調製
複数の細胞がくっついた「凝集塊(ダブレット)」は、解析の天敵です。例えば、陰性細胞と陽性細胞がくっついていると、全体として「陽性」と誤判定されてしまう可能性があります。
調製時には、ピペッティングやセルストレーナー(メッシュ)を通して単一細胞浮遊液(シングルセルサスペンション)にすることが基本です。さらに解析時には、FSC-A(面積)とFSC-H(高さ)のパラメータを用いて、電気的にダブレットを除去するゲーティングを必ず組み込みましょう。
死細胞による非特異的吸着の低減とViability Dyeの活用
死細胞は細胞膜の透過性が高くなっており、抗体を非特異的に吸着しやすい性質があります。これをそのまま解析すると、本来は陰性の細胞が陽性として検出され、データの信頼性を大きく損ないます。
FSC/SSCの散乱光パターンだけで死細胞を除去するのは不完全です。必ずViability Dye(7-AAD、PI、または固定可能なAmine reactive dyeなど)を使用して死細胞を特異的に染色し、解析対象から除外(ダンプチャンネルとして設定)する工程を入れましょう。これにより、生細胞のみの正確なフェノタイプ解析が可能になります。
固定・膜透過処理が蛍光強度に与える影響の考慮
細胞内サイトカインや核内因子を解析する場合、細胞を固定・膜透過処理(Fixation/Permeabilization)する必要があります。しかし、固定剤の種類や処理時間によっては、表面抗原の蛍光強度が低下したり、バックグラウンドが上昇したりすることがあります。
また、GFPなどの蛍光タンパク質を発現している細胞では、固定によってその蛍光が失われることもあります。使用する抗体や蛍光色素が固定処理に耐性があるかを事前に確認し、必要であれば固定処理専用の試薬キットを選択するなど、プロトコルの最適化が求められます。
まとめ
本記事では、再生医療等製品の品質評価におけるフローサイトメトリーの重要性と、規制要件に準拠した具体的な運用方法について解説してきました。
フローサイトメトリーは、細胞の特性や純度を高感度かつ定量的に評価できる強力なツールですが、その信頼性を担保するためには、適切な機器管理、バリデーションされた試験法、そして標準化された検体調製プロセスが不可欠です。GCTP省令やICH Q2ガイドラインを深く理解し、科学的根拠に基づいた品質管理体制を構築することが、製品の承認取得、ひいては患者様への安全な医療提供へとつながります。
自社での体制構築が難しい場合は、専門的な受託解析サービスの活用も有効な選択肢の一つです。確実な品質評価フローを確立し、再生医療の発展に貢献していきましょう。
フローサイトメトリーによる細胞品質評価についてよくある質問

フローサイトメトリーを用いた品質評価に関して、現場担当者からよく寄せられる質問をまとめました。実務の参考としてご活用ください。
よくある質問(FAQ)
-
Q1. 分析法バリデーションで必要な検体数はどのくらいですか?
- A1. 厳密な決まりはありませんが、統計的な信頼性を確保するために、併行精度では最低3回(推奨6回)、室内再現精度などの評価では複数のロットや条件を用いて、トータルで十分なデータ数を確保することが望ましいとされています。
-
Q2. アイソタイプコントロールは必ず設定しなければなりませんか?
- A2. 以前は必須とされていましたが、現在はその限界も指摘されています。特にマルチカラー解析では、アイソタイプよりもFMO(Fluorescence Minus One)コントロールの方が、ゲーティングの根拠として科学的に妥当性が高いと評価される傾向にあります。
-
Q3. 死細胞除去試薬(Viability Dye)はすべての試験で必要ですか?
- A3. 基本的には使用を強く推奨します。死細胞は抗体を非特異的に吸着しやすく、偽陽性の主な原因となるためです。正確な純度試験や特性解析を行うためには、死細胞を解析対象から除外することが重要です。
-
Q4. 異なる機種のフローサイトメーターで測定したデータは比較できますか?
- A4. 機種によって光学系や感度が異なるため、単純な数値比較は避けるべきです。比較が必要な場合は、標準ビーズを用いてMFI(蛍光強度)を標準化するか、同一のバリデーション手順で同等性を確認する必要があります。
-
Q5. 外部の受託解析サービスを利用する際の注意点は?
- A5. 委託先がGLP(優良試験所基準)やGCTPに準拠した管理体制を持っているかを確認することが重要です。また、試験法の技術移管(トランスファー)がスムーズに行えるよう、事前に詳細な試験計画書を作成し、認識を合わせておくことが成功の鍵です。
<script type="application/ld+json">
{
"@context": "https://schema.org",
"@type": "FAQPage",
"mainEntity": [
{
"@type": "Question",
"name": "分析法バリデーションで必要な検体数はどのくらいですか?",
"acceptedAnswer": {
"@type": "Answer",
"text": "厳密な決まりはありませんが、統計的な信頼性を確保するために、併行精度では最低3回(推奨6回)、室内再現精度などの評価では複数のロットや条件を用いて、トータルで十分なデータ数を確保することが望ましいとされています。"
}
},
{
"@type": "Question",
"name": "アイソタイプコントロールは必ず設定しなければなりませんか?",
"acceptedAnswer": {
"@type": "Answer",
"text": "以前は必須とされていましたが、現在はその限界も指摘されています。特にマルチカラー解析では、アイソタイプよりもFMO(Fluorescence Minus One)コントロールの方が、ゲーティングの根拠として科学的に妥当性が高いと評価される傾向にあります。"
}
},
{
"@type": "Question",
"name": "死細胞除去試薬(Viability Dye)はすべての試験で必要ですか?",
"acceptedAnswer": {
"@type": "Answer",
"text": "基本的には使用を強く推奨します。死細胞は抗体を非特異的に吸着しやすく、偽陽性の主な原因となるためです。正確な純度試験や特性解析を行うためには、死細胞を解析対象から除外することが重要です。"
}
},
{
"@type": "Question",
"name": "異なる機種のフローサイトメーターで測定したデータは比較できますか?",
"acceptedAnswer": {
"@type": "Answer",
"text": "機種によって光学系や感度が異なるため、単純な数値比較は避けるべきです。比較が必要な場合は、標準ビーズを用いてMFI(蛍光強度)を標準化するか、同一のバリデーション手順で同等性を確認する必要があります。"
}
},
{
"@type": "Question",
"name": "外部の受託解析サービスを利用する際の注意点は?",
"acceptedAnswer": {
"@type": "Answer",
"text": "委託先がGLP(優良試験所基準)やGCTPに準拠した管理体制を持っているかを確認することが重要です。また、試験法の技術移管(トランスファー)がスムーズに行えるよう、事前に詳細な試験計画書を作成し、認識を合わせておくことが成功の鍵です。"
}
}
]
}
</script>